
近视是一个全球性问题,目前正以流行的速度在世界范围内蔓延。尽管屈光不正可通过矫正快速改善,但近视患者(尤其是高度近视患者)在晚年易患潜在致盲性眼病。尽管近视相关研究众多,但近视发生发展的分子/细胞机制尚未完全明确,这阻碍了最有效的药物控制方案的研发。因此,多项旨在减缓儿童发育期眼球近视进展的研究正在进行中。迄今为止,抗胆碱能阻断剂阿托品是最有效的药物,临床医生已通过超适应症用药的方式将其用于近视控制。尽管其确切作用机制仍不明确且存在争议,但阿托品通过与眼内不同组织的受体在多个层面发生复杂相互作用发挥作用,因此可被视为一种“广谱性”近视治疗方案。本综述将简要概述与阿托品介导近视控制作用相关的生物学机制。
一、近视的全球流行现状与危害
近视是全球最常见的屈光不正,已成为致盲的主要原因之一¹。一项涵盖全球145项研究、210万名参与者的系统综述和荟萃分析显示,2000年全球近视和高度近视的患病率分别约为23%和2.7%²。据预测,到2050年,近视患病率将升至近50%,影响全球48亿人,这意味着未来约30年内,每两名儿童中就有一人会患上近视。
近视的发病率因种族和地理位置而异:东亚城市人口的近视患病率约为85%(尤其在台湾³⁻⁴和新加坡⁵),美国为44%⁶;而在蒙古农村(5.8%)⁷、尼泊尔博卡拉(4.05%)⁸等欠发达地区,患病率则显著更低。
近视与多种并发症风险增加相关,包括视网膜脱离、黄斑变性、黄斑裂孔、早发性青光眼、白内障⁹,甚至视力丧失¹⁰,且近视度数越高,风险越大。视网膜脱离的年发病率随近视度数升高而增加(>4.74D近视者为0.015%,>5.00D近视者为0.07%,>6.00D近视者为3.2%)¹¹。黄斑脉络膜新生血管的发病风险也与近视度数相关:1.00-2.00D近视者风险增加2倍,3.00-4.00D近视者增加4倍,5.00-6.00D近视者增加9倍¹²。
近视屈光不正带来的经济负担估计为每年2020亿美元,其中用于近视矫正的直接成本每年至少达38亿美元¹³⁻¹⁴。这些因素使得近视管理面临重大挑战,近视预防已成为主要的公共卫生问题³。
二、近视的核心特征与现有干预策略
近视的核心特征是眼球玻璃体腔深度增加导致眼轴过度伸长,使远处物体发出的光线聚焦于视网膜前方,形成模糊影像。换句话说,近视患者的眼轴长度与晶状体和角膜的屈光力不匹配,眼轴长度相对过长。
近视是一种复杂的多因素疾病,由环境和遗传风险因素相互作用调控¹⁵,其发生是由于眼球未能实现或维持正常的正视化过程(正视化本质上是眼球的内源性调节过程)¹⁶。近视通常在儿童学龄期发生,多数人在青春期后进展逐渐稳定。
过去40年来,多项流行病学和动物研究探讨了近视发生的可能原因。多种环境因素在学龄儿童近视发展中起重要作用,包括户外活动时间¹⁷、近距离用眼¹⁵、长期高强度学习¹⁸和城市化进程¹⁹。然而,尽管近视研究众多,其发生发展的分子/细胞机制仍未完全明确,这阻碍了最有效的药物控制方案的研发。因此,目前尚无明确方法可预防近视发生、完全阻止或逆转其进展。
现有近视防控策略的核心目标是有效管理疾病,具体包括:通过增加户外活动时间²⁰、减少近距离用眼时长²¹、药物干预²²、其他光学矫正方案(如双焦点镜片、多焦点镜片、渐进多焦镜片、软性双焦点隐形眼镜和角膜塑形镜)²³⁻²⁴,以及临床屈光矫正(如框架眼镜、隐形眼镜或手术)²⁵,来延迟儿童发育期眼球的近视发病或减缓其进展。
三、阿托品在近视控制中的应用现状
药物干预被证实是有效的近视控制方法²⁶⁻²⁷。抗胆碱能药物是一类可阻断乙酰胆碱在副交感神经支配结构和平滑肌上的毒蕈碱受体(MRs)作用的药物。乙酰胆碱在视网膜发育中起重要作用²⁸,并调控眼球生长²⁹。
2011年Cochrane数据库的系统综述显示,该类药物中多种药物在减缓近视进展方面表现出不同疗效³⁰。然而,仅硫酸阿托品²⁹、³¹⁻³³(一种非选择性、广谱毒蕈碱乙酰胆碱受体拮抗剂)和哌仑西平³⁴⁻³⁵(一种对MR 1亚型具有选择性的拮抗剂)在严格临床试验中显示出临床有效性。
多项研究表明,儿童每日眼表应用1%或更低浓度的阿托品,可呈剂量依赖性减缓近视进展:1%浓度时,睫状肌麻痹验光等效球镜度数变化和眼轴长度伸长分别减少高达80%和95%²⁹。同样,2%哌仑西平的近视控制效果为50%,但需每日给药两次(阿托品为每日一次)³⁵。然而,由于监管和经济限制,哌仑西平的临床试验已暂停³⁶。因此,阿托品是目前唯一经证实具有疗效、可通过超说明书用药用于近视治疗的抗胆碱能药物²⁶、³⁰。
不同浓度阿托品的疗效与安全性
ATOM2研究第一阶段显示,治疗两年后,与历史安慰剂组相比,0.5%、0.1%和0.01%阿托品组的睫状肌麻痹验光近视进展分别减少75%、70%和60%;眼轴长度伸长方面,0.5%和0.1%阿托品组分别减少29%和26%,而0.01%阿托品组未观察到明显的眼轴伸长抑制效果³⁷。
较近期的低浓度阿托品近视进展(LAPMP)安慰剂对照研究显示,治疗一年后,0.05%、0.025%和0.01%阿托品组的近视进展分别减少67%、43%和27%,眼轴长度伸长分别减少51%、29%和12%³³。
尽管这些研究的策略和试验持续时间不同,无法直接比较,但需注意的是:两项研究中,仅0.01%阿托品组与安慰剂组的等效球镜度数平均变化存在显著差异,眼轴长度伸长差异无统计学意义;且两年后,0.01%阿托品组的眼轴长度伸长显著大于其他更高浓度组(0.1%和0.5%)³⁷。不过,组间差异较小,无临床意义。
考虑到眼轴伸长在近视进展中的重要性,0.01%阿托品的近视控制效果可能存在不确定性,但需谨慎下结论,并考虑停药后阿托品的长期影响³⁸。
阿托品的副作用与反弹现象
阿托品的使用与多种眼部副作用相关,包括散瞳、畏光、眩光、局部过敏反应、调节功能丧失和近距离视力模糊(睫状肌麻痹),这些副作用通常在停药后逐渐消失,且在高浓度时更常见,呈剂量依赖性³¹。
事实上,使用1%阿托品的儿童畏光发生率为100%,导致研究脱落率高达16%-58%³⁹。相反,低浓度阿托品(0.5%和0.25%)的畏光发生率分别降至22%和7%,0.1%阿托品组则无畏光病例⁴⁰。同样,ATOM2研究中,仅7%使用0.01%阿托品的参与者出现畏光并需要变色眼镜³¹。
除了暂时性副作用外,阿托品治疗还存在更明显的反弹现象,停药后,治疗眼的近视进展速度快于未治疗眼。且反弹效应在高浓度阿托品组更显著:0.5%、0.1%和0.01%阿托品组停药后(洗脱期),分别有68%、59%和24%的参与者近视度数增加超过0.50D³¹。
实际上,洗脱期内,0.01%阿托品组的等效球镜度数平均变化和眼轴长度伸长最小(P<0.001)³⁸;而此前使用0.1%和0.5%阿托品的组,近视进展持续稳定,仅在第三阶段重新使用0.01%阿托品后才减缓。这表明,阿托品(尤其是高浓度)可能会在调控眼球生长的机制中诱导复杂、持久的生化变化。逐步减量使用阿托品可能减少反弹效应,但这方面尚未进行详细研究。
总体而言,五年期间,0.01%阿托品组的总体近视进展最低,等效球镜度数和眼轴长度伸长变化最小,视觉副作用也最轻微。长期使用阿托品可能与眼压升高和青光眼风险相关,但临床研究表明,阿托品治疗对儿童高眼压无影响⁴¹⁻⁴²,阿托品诱导青光眼的风险低至0.005%⁴³。因此,迄今为止,0.01%阿托品显示出最佳的治疗指数(适宜的风险-获益比),总体效果更优,且相较于高剂量,作用更温和、持久³¹、³⁸。
尽管有报道称,0.05%阿托品的近视抑制效果优于0.01%,且一年期间对视觉相关生活质量无不良影响³³,但在其被验证并常规应用于临床实践之前,仍需更多关于0.05%阿托品长期疗效(尤其是对近视反弹的影响)的信息。
0.01%阿托品的近视控制效果在亚洲以外地区也得到了验证,在美国不同种族的儿童中,其疗效已得到证实(但该结果基于非睫状肌麻痹验光数据)³²。事实上,0.01%阿托品制剂已以Myopine为商品名实现商业化,目前已在新加坡和马来西亚通过“指定患者”批准上市,并已在欧洲和亚洲的15个国家获得许可⁴⁴。然而,阿托品减缓近视进展的确切作用机制仍不明确,尚处于推测阶段。
四、阿托品作用的细胞受体机制
药理学上,阿托品是一种可逆性竞争性拮抗剂,对乙酰胆碱的五种毒蕈碱受体亚型(MR1-MR5)均具有亲和力,因此推测其近视保护作用主要通过毒蕈碱受体介导。毒蕈碱受体属于G蛋白偶联受体(GPCRs)超家族,在眼内既有神经元分布,也有非神经元分布。
在哺乳动物中,毒蕈碱受体广泛分布于眼内不同组织,包括角膜、虹膜、睫状体、睫状肌⁴⁵、晶状体上皮⁴⁶、视网膜(无长突细胞)、视网膜色素上皮⁴⁷、脉络膜和巩膜(巩膜成纤维细胞)⁴⁸⁻⁴⁹。
然而,多项研究报道,阿托品可能在眼内不同组织中与其他非毒蕈碱受体发生潜在的脱靶直接或间接相互作用,例如α₂A肾上腺素能受体(αAR)⁵⁰、γ-氨基丁酸受体(GABA-R)⁵¹和受体酪氨酸激酶(RTKs)⁴⁸。αAR和GABA-R均是GPCR家族的已知成员;表皮生长因子受体是RTKs的ErbB家族成员,通过经典的丝裂原活化蛋白激酶通路等细胞内信号通路调控原代巩膜成纤维细胞的增殖⁴⁸。研究表明,阿托品可呈剂量依赖性降低小鼠原代巩膜成纤维细胞的表皮生长因子受体活性⁴⁸。因此,阿托品可被视为一种“广谱性”近视治疗方案。
这一推测得到了一项近期研究的支持:该研究分析了1%眼表阿托品在兔眼内的药代动力学,发现阿托品在大多数眼组织中具有良好的生物利用度,给药后3天,其浓度仍比结合亲和力(0.4-0.7nM)高出两倍以上⁵²。尽管给药后5小时,阿托品在前部组织中的穿透力更强(浓度梯度:结膜最高,晶状体最低),但24小时后,观察到其与后部组织的结合增加,初始浓度梯度逆转(后部巩膜最高,其次是视网膜)。
除了对不同生物受体的拮抗特性外,阿托品还可作为MR3的反向激动剂,且可能对所有其他MR亚型均有反向激动作用,体外研究显示,阿托品可呈浓度依赖性降低受体的基础活性⁵³。
五、阿托品控制近视的关键生物学机制
最初使用阿托品进行近视控制是基于历史原因:当时推测眼球过度调节是近视发生的原因,而阿托品通过暂时麻痹平滑肌睫状肌,导致睫状肌麻痹(暂时丧失调节能力/聚焦远近物体的能力)。
然而,后来的动物研究发现,近视发生与非调节机制相关:无论是由于埃丁格-韦斯特法尔核(虹膜括约肌和睫状肌的副交感神经支配中枢)损伤⁵⁴,还是视神经切断⁵⁵导致无法调节的眼球,均会对施加的远视性离焦产生代偿并发展为近视。此外,研究发现,阿托品可减少鸡眼的形觉剥夺性近视⁵⁶,而鸡眼的横纹眼内肌上表达的是乙酰胆碱烟碱受体而非毒蕈碱受体⁵⁷。因此,研究焦点已转向探索近视发生的非调节机制。
相应地,多项生物学机制已被深入研究以阐明近视的成因,包括:视网膜对环境信号的信号通路功能障碍⁵⁸⁻⁶⁰、视网膜色素上皮通过脉络膜将眼球生长调控信号从视网膜传递至巩膜的作用⁶¹⁻⁶³、脉络膜厚度减少⁶⁴⁻⁶⁵,以及巩膜细胞外基质重塑导致的巩膜变薄⁶⁶⁻⁶⁷。
观察发现,阿托品可调节这些生物学机制,且主要靶向视网膜和巩膜,尽管也有报道称阿托品对脉络膜⁶⁸⁻⁶⁹和视网膜色素上皮⁷⁰有作用。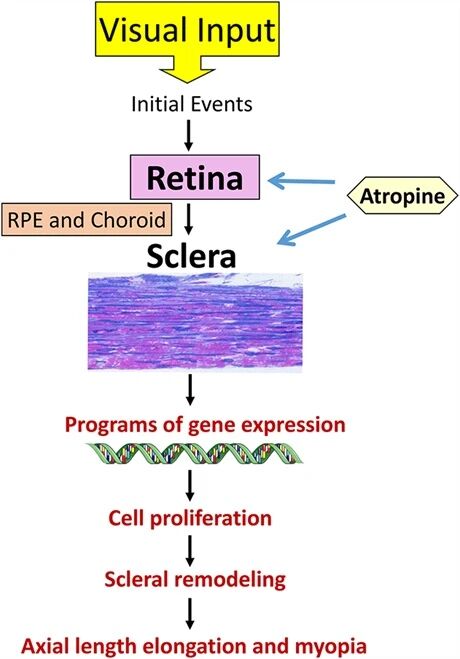
图1动物模型中介导近视发生的信号级联示意图
现有证据表明,视网膜和巩膜之间的相互作用参与近视发生。然而,这主要来自动物模型研究,在这些研究中,佩戴镜片施加的光学离焦等视觉信号是驱动眼轴伸长的主要因素。这些视觉输入启动视网膜内的特定分子事件,然后生长调控信号通过视网膜色素上皮和脉络膜传递至巩膜,促进基因表达、细胞增殖和巩膜重塑,进而导致眼轴伸长和近视发生。
人类近视的发生发展中,遗传和环境因素也可能起作用,对此我们知之甚少。此外,我们尚不明确人类眼内组织间通讯的性质,这种通讯可能非常复杂,且在近视发展的不同阶段可能发生变化。阿托品靶向视网膜和巩膜中的生物受体,以抑制近视进展。
视网膜的作用
视网膜是衬于眼球后部内表面的感光感觉层。玻璃体内注射阿托品可增加鸡视网膜中多巴胺的释放及其代谢产物DOPAC的浓度⁷¹。多巴胺是一种神经递质,可促进神经元间信号传导,在眼球生长和近视发生中起关键作用⁷²⁻⁷³。
多巴胺激动剂(如阿扑吗啡)可在形觉剥夺性⁷⁴和镜片诱导性近视⁷⁵两种近视诱导动物模型中抑制近视进展。研究还发现,阿托品可降低镜片诱导性近视小鼠视网膜中升高的γ-氨基丁酸转运体1(GAT-1)和γ-氨基丁酸转运体3(GAT-3)蛋白水平(GAT-3降低程度较小),这表明γ-氨基丁酸能信号通路参与阿托品对小鼠眼的抗近视作用⁵¹。
神经视网膜中的γ-氨基丁酸能传递在动物眼球生长和屈光发育的调节中起关键作用⁷⁶。另一方面,γ-氨基丁酸转运体通过促进γ-氨基丁酸重摄取到突触前神经元和周围神经胶质细胞,清除突触间隙中的γ-氨基丁酸,从而终止γ-氨基丁酸能传递⁷⁷。
需要注意的是,研究显示,阿托品可呈剂量依赖性抑制视网膜胆碱能无长突细胞、毒蕈碱受体和胆碱乙酰转移酶(ChAT,一种合成乙酰胆碱的酶)活性被破坏的鸡的形觉剥夺性近视⁷⁸。这表明,至少在形觉剥夺性近视中,视网膜毒蕈碱受体不介导阿托品的生长抑制作用,提示其他眼组织中的毒蕈碱受体可能参与其中。
巩膜的作用
巩膜是一种特殊的纤维结缔组织,构成眼球的保护性外层。眼球过度轴伸长导致屈光不正和近视发生,这可归因于巩膜组织重塑增加导致的巩膜变薄。在这种重塑过程中,巩膜会发生特定的分子和生化事件,最终导致组织的结构和生物力学变化,使细胞外基质变弱,巩膜组织显著变薄(详见其他文献综述⁷⁹)。
阿托品也可在巩膜水平抑制近视进展。这一推测得到以下证据支持:阿托品在体外可降低小鼠巩膜成纤维细胞的增殖⁴⁸;增加鸡⁸⁰和小鼠⁶⁷近视模型眼的巩膜纤维层厚度;减少形觉剥夺鸡眼的整体巩膜和分离巩膜软骨细胞中糖胺聚糖的合成,从而降低细胞外基质的产生⁸¹;并上调镜片诱导性近视小鼠巩膜中MR1、MR3和MR4的mRNA水平,同时下调MR2和MR5的mRNA水平⁶⁷。
视网膜色素上皮和脉络膜的作用
视网膜色素上皮是一层高度特化的色素细胞,位于神经视网膜和血管性脉络膜之间,在维持视网膜稳态中起重要作用。研究表明,视网膜色素上皮可将生长调控信号从视网膜传递至脉络膜和巩膜,并在体外调节巩膜生长和改变巩膜糖胺聚糖含量⁶¹⁻⁶²。
将镜片诱导性近视鸡眼的体外视网膜色素上皮与非近视眼的原代巩膜成纤维细胞共培养,可增加巩膜成纤维细胞的增殖并降低其糖胺聚糖含量⁶¹。相比之下,体外视网膜与原代巩膜成纤维细胞共培养对后者的DNA或糖胺聚糖含量无影响,而脉络膜与巩膜成纤维细胞共培养仅增加糖胺聚糖含量。这表明,尽管离焦生长调控信号起源于视网膜,但很可能存在于视网膜色素上皮中,且在一定程度上可能存在于脉络膜中。
脉络膜是眼球的血管层,为外层视网膜提供氧气和营养。脉络膜通过机制性调节自身厚度,使视网膜适应眼球的焦平面以应对施加的光学离焦(脉络膜调节),因此在正视化过程中起积极作用⁶³。研究发现,阿托品可抑制鸡镜片诱导性近视模型的近视发生,并快速诱导短暂的脉络膜增厚⁶⁸。同样,阿托品可消除远视性离焦信号在人类近视眼中诱导的脉络膜变薄,而不改变基线脉络膜厚度⁶⁹。
视网膜色素上皮(基底表面)和脉络膜均可分泌多种生长因子,包括转化生长因子和碱性成纤维细胞生长因子。研究表明,阿托品可在体外调节这些生长因子(不同亚型)的表达和活性水平:通过阻断视网膜色素上皮细胞中的毒蕈碱受体,抑制转化生长因子-β2的表达和分泌⁸²;并呈剂量依赖性降低小鼠原代巩膜成纤维细胞中转化生长因子-β1的活性水平,同时增加碱性成纤维细胞生长因子2的活性水平⁴⁸。
转化生长因子-β1可呈剂量依赖性刺激体外原代巩膜成纤维细胞的胶原蛋白合成,因此被认为参与近视发生过程中的巩膜重塑调控⁸³。另一方面,碱性成纤维细胞生长因子2可激活小鼠巩膜成纤维细胞中Ras/丝裂原活化蛋白激酶介导的信号通路⁴⁸,并刺激巩膜成纤维细胞增殖⁸⁴。
六、未来展望
0.01%阿托品似乎是一种有效的药物,可减缓发育期眼球的近视进展。然而,这一结果主要基于其在抑制屈光度数变化方面的持续作用,而其在抑制眼轴长度伸长方面的效果相对较弱。阿托品的确切作用机制和作用部位也仍不明确。
此外,毒蕈碱机制本身在近视发生中的作用尚未得到专门研究。尽管0.01%阿托品的副作用轻微且为短期表现,但在ATOM2研究的0.01%阿托品组中,24%的参与者出现近视反弹,7%出现轻度副作用(未严重到需要停药),9.3%的参与者对治疗反应不佳,初始治疗两年内近视进展超过1.5D。0.1%和0.5%阿托品组的“治疗反应不佳者”比例分别为6.4%和4.3%。
同样,在其他研究中,0.5%阿托品组11%的儿童每年近视度数增加超过0.75D⁸⁵;而0.1%、0.25%和0.5%阿托品组分别有33%、17%和4%的儿童每年近视度数增加超过1D,对照组为44%⁴⁰。另一项研究发现,45%的参与者对0.05%阿托品反应不佳,6个月内近视进展超过0.5D⁸⁶。然而,当改用0.1%阿托品后,在4.5年的随访期间,仅20%的参与者每年近视进展超过0.5D,而对照组为100%。
即使使用1%阿托品治疗,12%的儿童在治疗1年后仍持续每年近视进展超过0.5D,这些儿童通常年龄更小、近视度数更高,且父母均为近视患者⁸⁷。对于这类治疗反应不佳的患者,其治疗策略仍不明确。
多项研究,包括针对与阿托品试验年龄相似的儿童(6-12岁)发育期眼球的研究表明,屈光度数变化随年龄分布⁸⁸⁻⁸⁹,且成人人群中存在两个不同的高斯亚群,其屈光度数和眼轴长度分布模式不同,这可能归因于病因差异⁹⁰。
尽管大多数人群在儿童早期(6岁)为正视眼,屈光度数呈尖峰分布(峰形狭窄),但有一小部分人群为近视屈光,未能经历初始的正视化阶段(提示原发性稳态失衡)或实现早期正视化延迟(正视化不良)⁸⁸。随着眼球的生长,到11-12岁时,相当比例的人群仍接近正视眼(提示生长受调控),但屈光度数数据的分布范围扩大,并向负偏态分布转移,这表明存在另一部分人群,由于无法维持正视状态导致生长失调,开始向近视方向发展(继发性稳态失衡)。
需要注意的是,眼生物测量指标(眼轴长度和屈光度数)的分布呈双高斯分布,成人人群(20-70岁)中本质上存在两个亚群:正视化亚群(正视眼处有尖锐峰值,数据变异性小)和失调亚群(峰值更宽,数据分布/变异性增加,均值为近视)⁹⁰。因此,近视患者的发病要么源于原发性稳态失衡(尽管比例极低),要么源于继发性稳态失衡,因此需要干预以调控其眼球生长。
此外,并非所有眼球都会达到相同程度的正视化,部分低度数近视患者可能处于正视眼屈光度数分布的尾部(正视化不良)。因此,预计阿托品等干预措施对这两类近视患者(正视化不良者和稳态机制失败者)的效果会有所不同,这可通过其个体近视进展速度来判断。
特别是,阿托品对正视化不良者可能几乎无作用,这部分人群可能在一定程度上与“治疗反应不佳者”类别重叠。此外,也不能排除干预措施可能加重该人群近视程度的可能性。
阿托品使用的潜在长期眼部或全身副作用也令人担忧。多种抗胆碱能药物和其他具有抗胆碱能特性的药物与中枢副作用相关,会对认知功能产生不利影响⁹¹。尽管这在抗胆碱能负荷高的老年人中尤为明显,但中年时期即使长期接触轻度抗胆碱能药物,也可能增加老年时期的患病风险⁹²。
鉴于东亚部分临床医生主张对近视儿童持续使用低剂量阿托品直至青春期后期(此后近视通常稳定),因此需要彻底研究早期长期接触阿托品(一种抗胆碱能药物)的长期中枢效应。
综上所述,需要深入研究阿托品预防近视发生的作用机制,以开发疗效更高、短期/长期不良反应最小的靶向治疗方案。此外,还需要确定新的药物靶点,并为对阿托品治疗无反应的患者亚群开发替代治疗策略。
参考文献:略








