专家点评

视网膜母细胞瘤是儿童眼内最常见的恶性肿瘤,临床上治疗以化疗或动脉介入化疗以及眼球摘除等为主,患儿在生存与视力保留之间往往面临艰难抉择。金子兵教授团队此次在《IOVS》发表的工作,是视网膜母细胞瘤免疫治疗领域的一次开启式进展。早在2020年,该团队在国际上首次通过多能干细胞分化方法构建视网膜母细胞瘤类器官(PNAS 2020),2022年通过RB患者iPS细胞分化成类器官直接证实了Knuson提出的“双重打击学说”,2024年首次揭示RB1缺失可过度激活小胶质细胞、加速视网膜结构破坏,为“以免疫制肿瘤”奠定了理论基础;如今,他们又把iPSC来源的小胶质细胞工程化为GD2-CAR“活体药物”,在RB类器官和原位眼内异种移植模型中实现了肿瘤负荷下降和生存期延长,充分体现出“组织驻留、低毒高效”的独特优势。这项研究不仅将眼科细胞治疗从概念验证推向临床前开发,更让我们第一次看到“保眼+保命”双重目标同时实现的希望。下一步,期待团队尽快开展儿童患者临床试验,让这一“中国方案”成为全球RB治疗的新跑道。

中枢神经系统肿瘤的治疗长期面临血-脑屏障阻挡、免疫微环境抑制和细胞药物持久性不足三大瓶颈。北京同仁医院金子兵教授团队独创“CAR-microglia”技术,把天然驻留眼内与脑内的小胶质细胞改造成GD2-CAR-小胶质细胞,在视网膜母细胞瘤模型中取得显著疗效,为“利用驻留免疫细胞突破屏障”提供了令人振奋的新范例。该研究巧妙结合团队已建立的视网膜类器官平台和小胶质细胞分化技术,系统证实CAR-小胶质细胞在视网膜母细胞瘤模型中展现出强大且安全的抗肿瘤活性。该成果不仅填补了眼科肿瘤免疫治疗的空白,更为胶质瘤、神经母细胞瘤等其它中枢神经系统肿瘤提供了可行的技术路径。下一步,期待团队在动物模型中进一步验证剂量窗口、制备工艺、安全性和持久性,推动这项“中国原创”的CAR-microglia成果尽快进入临床试验,为广大中枢神经系统肿瘤患者开辟一条安全、高效且可负担的精准免疫治疗新通道。

金子兵教授团队巧妙地把大脑和视网膜的“本土免疫细胞”—小胶质细胞—改造成携带GD2-CAR的“精准吞噬者”,在视网膜母细胞瘤模型中展现出强大且安全的抗肿瘤活性。该研究的最大亮点在于“平台化”思路:他们依托世界领先的视网膜类器官与小胶质细胞分化体系,从CAR构建、体外功能验证,再到原位眼内异种移植模型,形成了一条完整、可追溯、可转化的技术链条。高分辨率活细胞成像和单细胞RNA-seq数据进一步证实,CAR-microglia能在肿瘤微环境中维持吞噬表型并下调炎症信号,为“低炎症免疫治疗”提供了全新范例。未来,这一策略不仅有望拓展到GD2阳性的神经母细胞瘤、胶质母细胞瘤等其他CNS恶性肿瘤,也为利用组织驻留免疫细胞开发下一代活体药物指明了方向。希望团队尽快推进转化和临床试验,早日实现让全球更多患者受益于这一具有“中国智慧”的创新疗法。

近日,眼科基础研究TOP期刊《Investigative Ophthalmology & Visual Science》(IOVS)上发表了题为“GD2-CAR-Engineered Microglia Exhibit Antitumor Effects in Organoids and Animal Models of Retinoblastoma”的研究论文。该研究首次报道了利用人诱导多能干细胞(iPSC)分化的嵌合抗原受体(CAR)-小胶质细胞(CAR-mi)治疗视网膜母细胞瘤(RB)的全新策略,为这一儿童常见恶性眼内肿瘤的治疗带来了新的曙光。
前期基础:类器官模型与小胶质细胞分化技术的突破
研究团队在视网膜母细胞瘤研究领域深耕多年,积累了丰富的前期成果。2020年,团队首次在国际上成功构建了人源多能干细胞分化来源的视网膜母细胞瘤类器官模型,该模型在分化第60天前后出现RB肿瘤,在每种维度上与原发性视网膜母细胞瘤相同,并证明了RB肿瘤起源于趋向成熟的视锥前驱细胞。相关研究成果发表在《PNAS》杂志上(PNAS, 2020)。2022年,团队进一步收集视网膜母细胞瘤患儿的尿液上皮细胞,通过重编程得到患者特异性的诱导多能干细胞(iPSC),并分化出具有遗传背景的视网膜母细胞瘤类器官,首次证实了约翰霍普金斯大学Knuson教授于1971年提出的“双重打击学说”。相关文章发表于《PNAS Nexus》杂志上(PNAS Nexus, 2022)。同年,该团队在国际上首创了最高效分化小胶质细胞技术,细胞纯度可达95%以上且细胞功能完备,通过动态监测和分子实验确认了其吞噬和分泌功能,将其与视网膜类器官共培养后,使视网膜类器官结构更接近真实视网膜,相关成果作为封面文章发表在《Science China Life Sciences》杂志上(Sci China Life Sci, 2022)。2024年,团队进一步发现RB1缺失的人诱导多能干细胞分化来源小胶质细胞处于过度激活状态,分泌细胞因子水平升高,与视网膜类器官共培养后导致视网膜结构紊乱,证实了小胶质细胞在视网膜母细胞瘤发生发展中的关键作用,该成果发表于《GLIA》杂志上(Xu et al., Glia, 2024)。这些前期研究基础为CAR-小胶质细胞治疗视网膜母细胞瘤奠定了坚实基础。
主要结果:CAR-小胶质细胞的抗肿瘤效果
在本项研究中,团队聚焦于视网膜母细胞瘤的治疗,创新性地开发了人CAR-小胶质细胞。人诱导多能干细胞分化的CAR-小胶质细胞建立方法如图1所示。
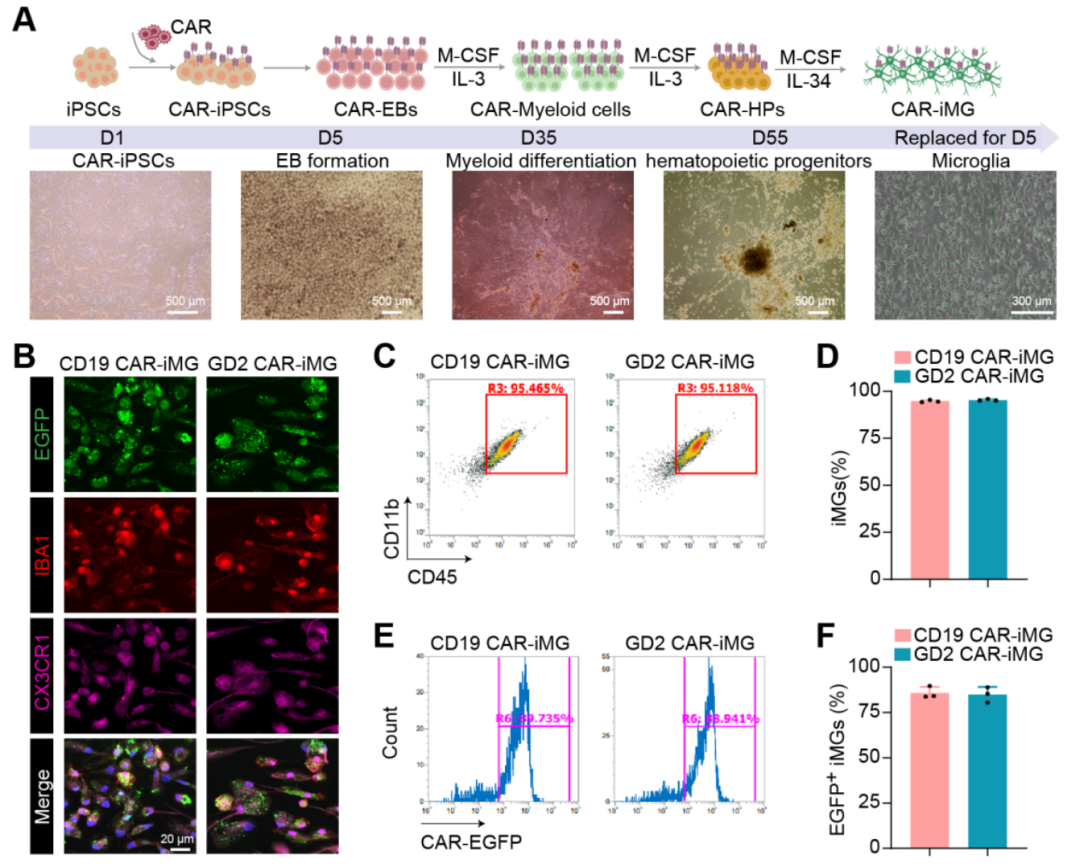
图1. 人诱导多能干细胞分化来源的GD2 CAR-小胶质细胞
进一步分析发现,从iPSC分化而来的CAR-小胶质细胞与已发表的人类小胶质细胞数据高度吻合。在体外实验中,GD2 CAR-小胶质细胞展现出对视网膜母细胞瘤细胞系(图2)及视网膜母细胞瘤类器官(图3)显著吞噬效果,通过活细胞成像技术清晰地观察到GD2 CAR-小胶质细胞吞噬肿瘤细胞的过程。
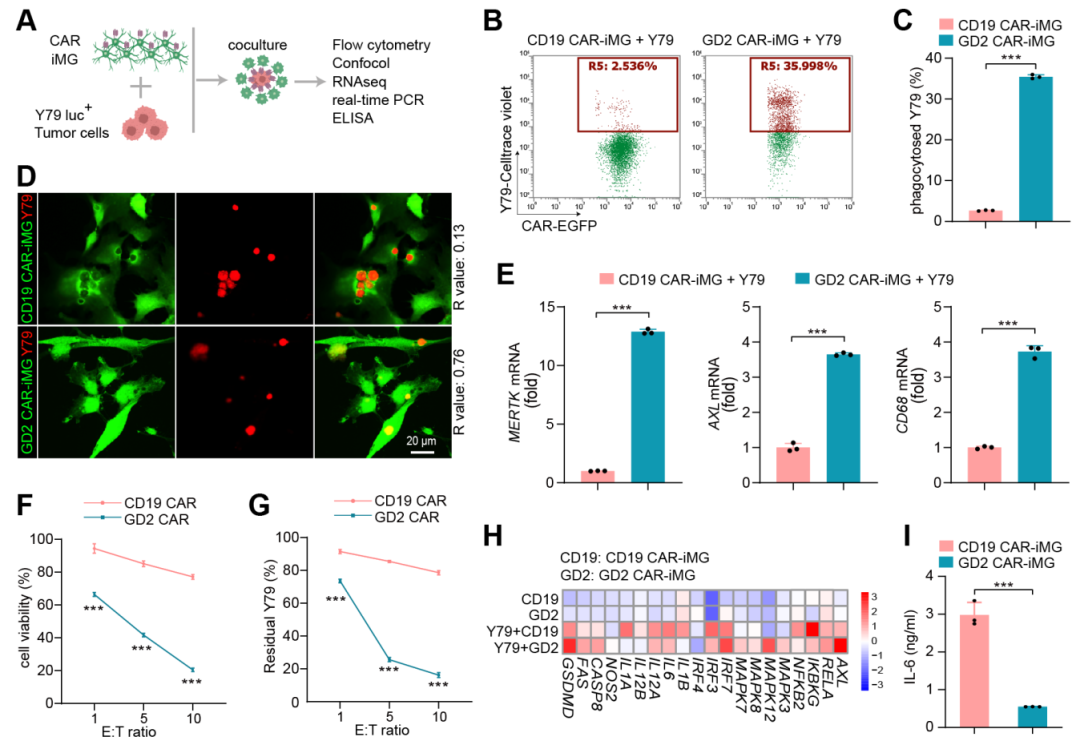
图2. 通过与RB细胞共培养观察到GD2 CAR-小胶质细胞抗肿瘤吞噬功能
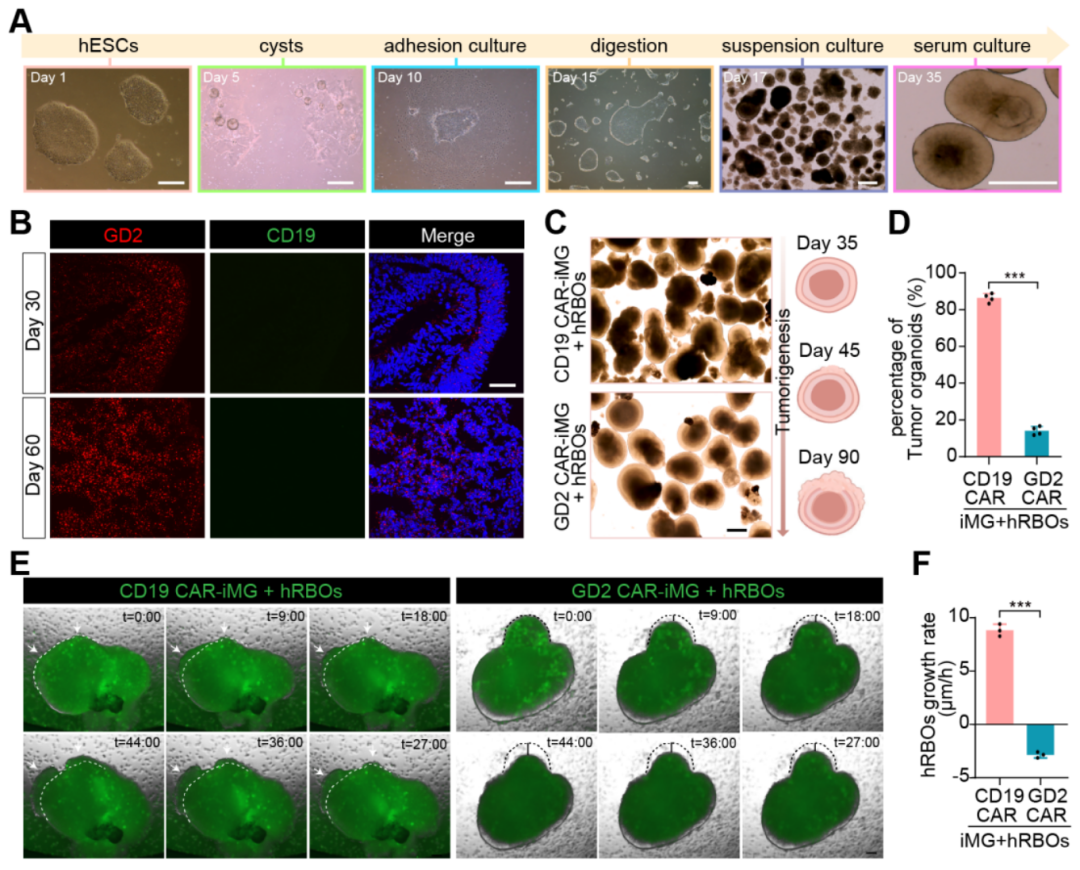
图3. 通过与RB类器官共培养明确了GD2 CAR-小胶质细胞的抗肿瘤功能
进一步的体内实验中,团队建立了视网膜母细胞瘤异种移植模型,通过小动物活体成像、光学相干断层扫描(OCT)和眼底照相等技术检测发现,CAR-小胶质细胞显著抑制了肿瘤的生长,并延长了小鼠的生存时间(图4)。
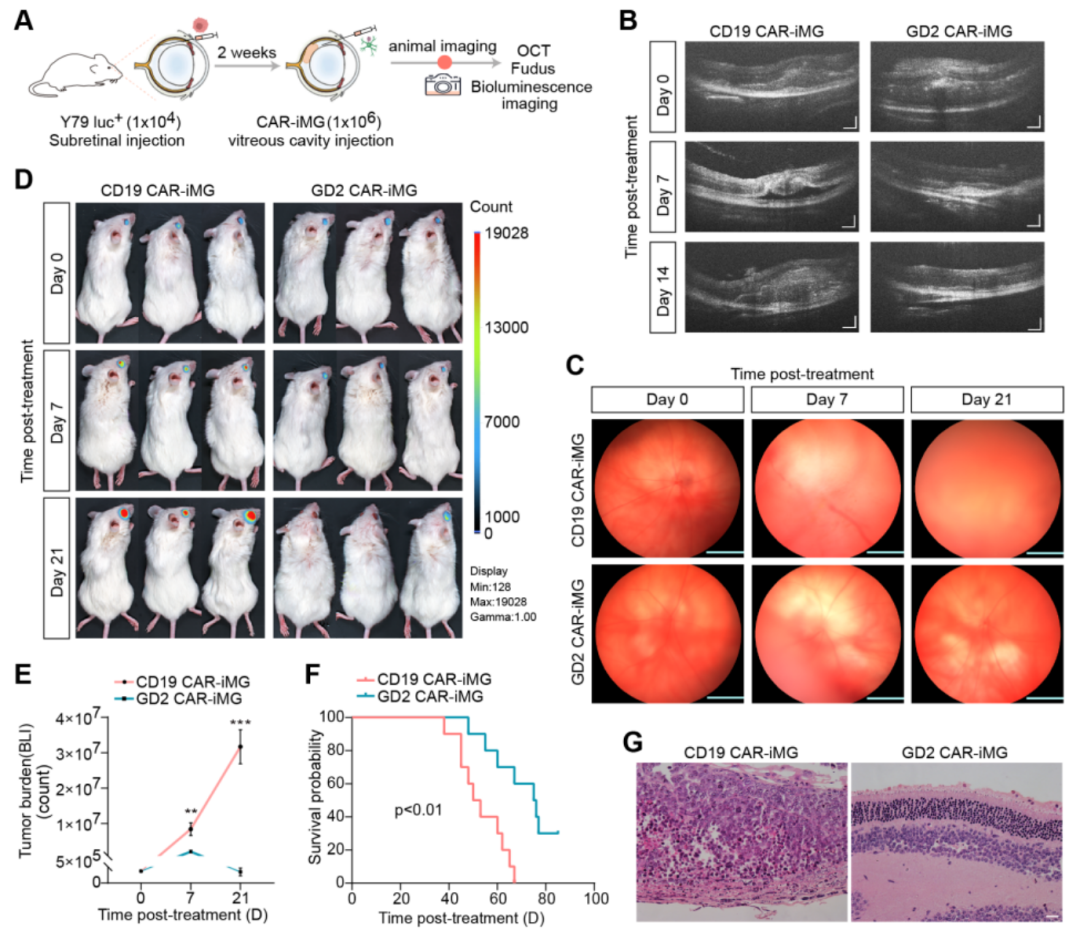
图4. GD2 CAR-小胶质细胞在RB动物模型中治疗效果显著
临床应用前景:开启视网膜母细胞瘤治疗新篇章
视网膜母细胞瘤是儿童常见眼内恶性肿瘤,目前的治疗方法亟待优化和开拓。金子兵教授团队的这项研究为视网膜母细胞瘤的治疗提供了全新的思路。CAR-小胶质细胞疗法利用中枢神经系统内源性免疫细胞——小胶质细胞,通过工程化改造使其表达嵌合抗原受体(CAR),从而特异性地识别并吞噬肿瘤细胞。与传统的CAR-T细胞疗法相比,CAR-小胶质细胞疗法具有潜在的优势:小胶质细胞作为中枢神经系统的驻留免疫细胞,能够更好地穿透血眼屏障,直接作用于肿瘤部位,减少全身免疫反应的风险。此外,小胶质细胞具有强大的吞噬功能,能够有效地清除肿瘤细胞碎片,抑制肿瘤复发。
该研究不仅在基础科研层面取得了重要突破,更为视网膜母细胞瘤的临床治疗带来了新的希望。未来,团队计划进一步优化CAR-小胶质细胞的设计,推进临床研究,以期将这一创新疗法推向临床应用,为视网膜母细胞瘤患者带来更安全、更有效的治疗方案。
首都医科大学附属北京同仁医院副院长金子兵教授为本文通讯作者,助理研究员许佳博士为第一作者,课题组硕士生高艺萌、王瑾宜、程幼敏以及眼科研究所工作人员吕萌和张志豹为本研究作出实际贡献,本研究在国家自然科学基金、北京市自然科学基金重点项目及北京市“扬帆计划”等支持下完成。
特别鸣谢:西湖大学谢琦教授在CAR方面的讨论指点以及眼科研究所工作人员杨静、孙舒宁、施丹丹和王雯博士在研究中的各方面协助。
相关文章链接
1. Xu, J., Gao, Y., Wang, J., Lyu, M., Zhang, Z., Cheng, Y., Jin, Z. B. (2025). GD2-CAR–Engineered Microglia Exhibit Antitumor Effects in Organoids and Animal Models of Retinoblastoma. Invest Ophthalmol Vis Sci. 66(14):44219. https://doi.org/10.1167/iovs.66.14.26
2. Liu, H., Zhang, Y., Zhang, Y. Y., Li, Y. P., Hua, Z. Q., Zhang, C. J., Wu, K. C., Yu, F., Zhang, Y., Su, J., Jin, Z. B. (2020). Human embryonic stem cell-derived organoid retinoblastoma reveals a cancerous origin. Proc Natl Acad Sci U S A., 117(52), 33628–33638. https://doi.org/10.1073/pnas. 2011780117
3. Li, Y. P., Wang, Y. T., Wang, W., Zhang, X., Shen, R. J., Jin, K., Jin, L.-W., Jin, Z. B. (2022). Second hit impels oncogenesis of retinoblastoma in patient-induced pluripotent stem cell-derived retinal organoids: Direct evidence for Knudson's theory. PNAS Nexus, 1(4), pgac162. https://doi.org/10.1093/pnasnexus/pgac162
4. Gao, M. L., Zhang, X., Han, F., Xu, J., Yu, S. J., Jin, K., Jin, Z. B. (2022). Functional microglia derived from human pluripotent stem cells empower retinal organ. Science China-Life Sciences, 65(6), 1057–1071. Cover story. https://doi.org/10.1007/s11427-021-2086-0
5. Xu, J., Yu, S.-J., Sun, S., Li, Y.-P., Zhang, X., Jin, K., Jin, Z.-B. (2024). Enhanced innate responses in microglia derived from retinoblastoma patient-specific iPSCs. Glia, 72(5), 872–884. https://doi.org/10.1002/glia.24507








