自2017年首款视网膜基因治疗药物——用于治疗 RPE65 相关视网膜变性的 voretigene neparvovec(Luxturna,Spark Therapeutics)获批以来,遗传性视网膜疾病的治疗格局发生了显著变化。如今,基因检测已成为单基因遗传性视网膜疾病的标准诊疗流程[1],而视网膜专科医生则需不断学习,以跟上眼科领域中发展最快的分支——视网膜遗传学与基因治疗领域的最新进展。过去十年间,该领域发展迅猛,要全面概述所有遗传性视网膜疾病的视网膜基因治疗临床试验并非易事。本文将选取部分试验进展进行介绍,重点聚焦以下几种遗传性视网膜疾病:视网膜色素变性(侧重针对 RPGR 相关 X 连锁视网膜色素变性的基因增补疗法,以及针对视网膜色素变性的非基因依赖性光遗传学疗法)、Stargardt 病、Leber 先天性黑矇与 X 连锁视网膜劈裂症。
一、RPGR 相关视网膜色素变性的基因增补试验
Botaretigene sparoparvovec(bota-vec,Johnson & Johnson)是一款处于研究阶段的5型腺相关病毒(AAV5)载体基因治疗药物,目前正用于治疗由视网膜色素变性 GTP 酶调节因子(RPGR)基因突变引起的 X 连锁视网膜色素变性[2、3]。LUMEOS 研究[3]是一项3期随机对照多中心临床试验,旨在评估 bota-vec 双侧视网膜下给药治疗 RPGR 基因突变相关 X 连锁视网膜色素变性患者的疗效与安全性[3]。该研究的主要终点是从基线到第52周,通过患者在视力引导运动评估(Vision-Guided Movement Assessment,VMA) 迷宫中的导航能力,衡量 VMA 的变化情况[4]。第52周时,主要终点(VMA)虽在统计学上无显著差异,但具有趋势性支持[5]。
次要终点评估了治疗后患者视网膜功能、功能性视力及视觉功能的变化[5]。研究结果显示,多个次要终点均有改善,包括所有三个视觉领域的数据[5]。bota-vec 的安全性与预期一致且可控,3期研究中未发现新的安全信号[5]。总体而言,联合治疗组中100%的参与者至少经历过1次治疗期间出现的不良事件,其中86%为轻度或中度[5];略超半数(53%)的参与者出现至少1次被认为与 bota-vec 相关的不良事件,98%的参与者出现至少1次与手术操作相关的不良事件[5]。
Beacon Therapeutics 是一家处于临床阶段的生物技术公司,其核心研发项目为 laru-zova(通用名:laruparetigene zovaparvovec),这是一款目前正用于 X 连锁视网膜色素变性患者治疗研究的基因治疗药物。X 连锁视网膜色素变性是一种主要影响男性的遗传性视网膜疾病,通常由 RPGR 基因突变引起。在美国、欧洲和澳大利亚,约每25000名男性中就有1人受该基因突变影响;该突变会导致患者进行性感光细胞丢失,儿童时期即出现视觉功能障碍,最终发展为失明,且目前尚无获批治疗方案。Laru-zova 通过递送 RPGR ORF15 基因的功能性拷贝(该基因经设计可产生全长蛋白),有望恢复 X 连锁视网膜色素变性患者视杆细胞与视锥细胞的正常功能。
DAWN 研究是一项针对 laru-zova 的开放标签试验,研究对象为此前接受过基于 AAV 载体、可递送全长 RPGR 蛋白的基因治疗的 X 连锁视网膜色素变性男性患者,此次在其对侧眼使用 laru-zova[6]。该研究旨在评估两种剂量的 laru-zova 在“此前接受过 X 连锁视网膜色素变性基因治疗的参与者的未治疗眼”中的疗效、安全性与耐受性。2期 DAWN 试验的中期安全性与疗效数据显示,所有随访时间达到6个月及以上的 DAWN 参与者对 laru-zova 的耐受性普遍良好,初步数据显示患者多项关键视觉功能指标均有良好改善。目前,针对 X 连锁视网膜色素变性患者的 laru-zova 关键2/3期 VISTA 试验已完成入组。
VISTA 试验是一项2/3期随机对照设盲多中心关键研究,将两个研究组中 laru-zova 的疗效、安全性与耐受性,与未治疗对照组进行比较[7]。该研究将评估低亮度视觉视敏度较基线提升15个及以上字母的参与者比例,以及其他功能性视力指标。
二、ABCA4 相关 Stargardt 病的基因治疗
Ascidian Therapeutics 是一家专注于 RNA 外显子编辑技术的生物技术公司。ACDN-01 是一款通过单一载体递送的体内 RNA 外显子编辑药物,用于治疗 Stargardt 病,目前正处于1/2期 STELLAR 研究的评估阶段[8]。ACDN-01 可利用细胞自身的剪接机制,直接修正 ABCA4 信使 RNA(mRNA),将突变 RNA 替换为野生型 RNA。与 CRISPR 或 ADAR 技术不同,Ascidian 的技术平台可在单次反应中编辑数千个 RNA 碱基,从而能够治疗更广泛的患者群体。该技术已在非人灵长类动物视网膜中实现高效、持久的体内 RNA 外显子编辑,并在人类视网膜外植体中实现体外 RNA 外显子编辑。在非人灵长类动物研究中,ACDN-01 不仅成功编辑了 ABCA4 RNA,还产生了全长功能性 ABCA4 蛋白。ACDN-01 已获得美国 FDA 的罕见儿科疾病认定与快速通道资格,同时也是首个进入临床开发阶段的 RNA 外显子编辑药物,更是首个在其他国家获批临床试验前,先获得美国临床研究许可的 RNA 编辑治疗药物。
STELLAR 试验是针对 ACDN-01 的1/2期研究,旨在验证其安全性及早期疗效信号。该研究的主要终点聚焦安全性,疗效终点则包括评估萎缩进展速率的变化及视网膜功能。目前试验入组正在进行中,数据将在后续会议中逐步公布。该研究在美国设有10个研究中心,其中大部分中心接受外部转诊;此外,还设有一项独立的预筛选研究,同时面向儿童与成人患者开放。
SpliceBio 是一家处于临床阶段的基因药物公司,其开发了独特的基于蛋白剪接内含肽的双 AAV 载体平台,该平台能够递送常规 AAV 载体系统无法容纳的大型基因。目前,该公司正利用这项技术开发 SB-007—— 一款用于治疗由 ABCA4 基因功能异常引起的 Stargardt 病的基因治疗药物[9]。SB-007 由携带 ABCA4 基因的双 AAV8 载体组成:ABCA4 基因被拆分为两段,每段均与经过工程改造的内含肽序列融合,这些内含肽序列可通过蛋白反式剪接,在靶细胞中重组形成全长功能性 ABCA4 蛋白[10、11]。在体内通过视网膜下注射给药时,SB-007 在小鼠和大鼠模型中表现出对视网膜感光细胞的高效转导,且其药理活性具有剂量依赖性(通过 A2E 水平降低来衡量)。在 ABCA4 基因敲除小鼠、大鼠以及野生型模型(猪和非人灵长类动物)中,均观察到 ABCA4 蛋白的完全重组。在一项为期6个月的大型关键非临床研究质量管理规范非人灵长类动物毒性研究中,SB-007 在所有测试剂量下均表现出良好的耐受性,且持续6个月无异常。2024年12月,SpliceBio 获得了 SB-007 的研究性新药批准[10、11]。2024年3月,该公司启动了一项名为 POLARIS 的观察性研究,旨在监测由 ABCA4 基因双等位基因常染色体隐性突变引起的1型 Stargardt 病患者的疾病进展情况[11、12]。2025年3月,SpliceBio 宣布已在 SB-007 治疗 Stargardt 病的1/2期 ASTRA 研究中完成首例患者给药。ASTRA 研究将评估 SB-007 视网膜下给药的安全性、耐受性及初步疗效,目标是确定1型 Stargardt 病患者的最佳给药剂量[9、11]。
三、Leber 先天性黑矇的基因治疗
Atsena Therapeutics 公司近期公布了一项1/2期临床试验的12个月安全性与疗效数据,该试验评估了视网膜下基因治疗药物 ATSN-101 用于治疗由 GUCY2D 基因双等位基因突变引起的1型 Leber 先天性黑矇患者的效果 [13]。
在剂量递增阶段(A 部分),3个队列(每队列入组3名成年患者)分别接受了3种递增剂量的 ATSN-101 治疗;在剂量扩展阶段(B 部分),额外纳入1个成年队列和1个儿童队列(每队列入组3名患者),均接受 A 部分中的高剂量 ATSN-101 治疗。所有不良事件的严重程度均为1-2级,其中大部分与手术操作相关,且无与研究药物相关的严重不良事件。接受高剂量 ATSN-101 治疗的患者中,治疗眼的暗适应全视野刺激试验平均变化为20.3分贝,相当于改善100倍,而未治疗眼的平均变化仅为1.1分贝;在9只接受高剂量治疗的眼中,有2只眼的暗适应全视野刺激试验改善超过40分贝(相当于改善10000倍)。此外,患者的最佳矫正视力也有适度改善(提升0.16logMAR,即8个字母),在6名接受高剂量治疗且完成多亮度运动测试的患者中,有3名患者在治疗后12个月时,治疗眼的多亮度运动测试评分达到满分。目前,Atsena Therapeutics 正推进 ATSN-101 的3期临床试验计划。
Opus Genetics 公司的研发管线包含7款基于 AAV 的基因治疗药物,每款均针对一种特定的遗传性视网膜疾病。OPGx-LCA5 是该公司进展最快的基因治疗项目,用于治疗5型 Leber 先天性黑矇。该药物采用 AAV8 载体,将功能性 LCA5 基因递送至视网膜外层,其使用的 CβA 启动子技术与 voretigene 药物相同。目前,OPGx-LCA5 的1/2期研究正在进行中,已有3名接受低剂量(1E10vg/眼)治疗的成年患者的12个月数据可用[14]。入组时,所有患者均患有严重的5型 Leber 先天性黑矇,感光细胞数量有限但可检测,且疾病已进展至视网膜中央区域。治疗12个月时,在用于评估功能性视力变化的基于虚拟现实的多亮度定向运动测试中,所有接受治疗的患者识别出的物体数量均较基线有所增加:3名患者中有2名在多亮度定向运动测试中实现了具有临床意义的改善(物体识别阈值提升3个及以上);第3名患者则从治疗前无法完成多亮度定向运动测试,转变为治疗12个月时能够完成测试。此外,3名患者的视力平均提升3.5行。
同时,全视野刺激测试显示,治疗眼的敏感度较基线有更大幅度改善:12个月时,治疗眼的敏感度提升0.86对数单位,而对照眼仅提升0.16对数单位。研究人员还收集了1名患者的微视野数据(另外2名患者因固视不良无法收集),治疗12个月时,该患者的固视变得稳定且向黄斑中心移位,这表明患者的中心视力有所改善,固视能力也随之提升(见图 1)。在长达12个月的随访中,OPGx-LCA5 的耐受性良好,未报告剂量限制性毒性或严重不良事件。
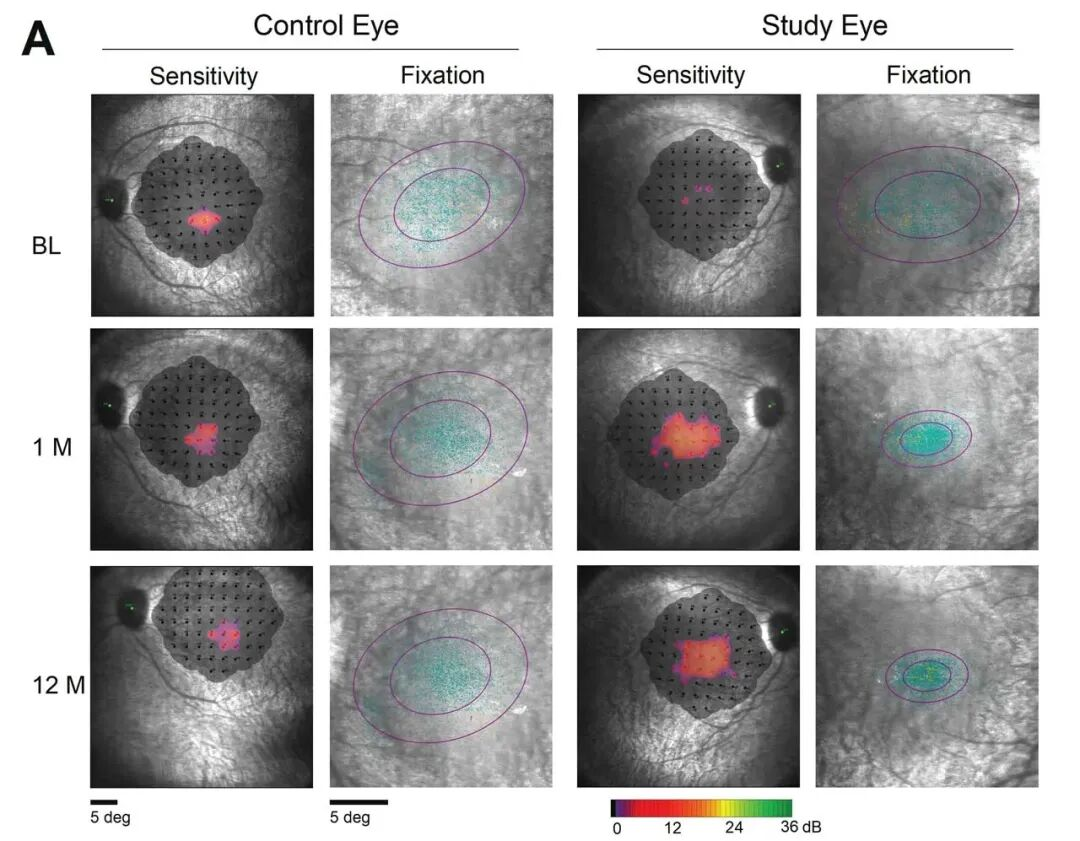
图1 根据2025年5月视觉与眼科研究协会(ARVO)年会公布的12个月数据,接受 OPGx-LCA5 治疗的患者黄斑敏感度改善超过18倍
目前已有3名儿童患者接受了 OPGx-LCA5 治疗,初步数据预计于2025年公布。此外,Opus 公司还在研发一款针对 BEST1 疾病的研究性基因治疗药物,并计划于2025年启动1/2期研究,初步数据预计于2026年初公布。
四、X 连锁视网膜劈裂症的基因治疗
LIGHTHOUSE 研究是由 Atsena Therapeutics 发起的一项1/2期临床试验,旨在评估视网膜下基因治疗药物 ATSN-201 用于治疗 X 连锁视网膜劈裂症的效果。ATSN-201 采用该公司研发的新型扩散型衣壳 AAV.SPR,能够在视网膜中央区域的感光细胞中实现治疗水平的基因表达,同时避免黄斑脱离的手术风险。该研究的 A 部分共纳入3个队列(每队列入组3名成年患者),通过视网膜下注射向患者单眼给药,评估3种剂量 ATSN-201 的安全性与耐受性。
根据2025年5月公布的数据,截至当时,所有9名接受 ATSN-201 治疗的患者均对药物耐受性良好,未报告与研究药物相关的严重不良事件[15]。大多数不良事件的严重程度为1-2级,且与手术操作相关;唯一报告的严重不良事件为“不明原因发热且检查结果阴性”,发生在治疗后7个月,被认为与 ATSN-201 或手术操作无关。研究中未出现剂量限制性毒性,也无患者退出试验。在所有3种剂量的 ATSN-201 治疗中,均观察到初步疗效证据:9只治疗眼中有7只实现了黄斑裂孔闭合;另外2只未实现黄斑裂孔闭合的眼睛中,1只的给药泡位置偏外周,另1只在术中激光治疗后出现了视网膜前膜。相比之下,未治疗眼均未观察到黄斑裂孔闭合。通常情况下,视网膜结构改善的眼睛,其视觉功能也会随之提升:在微视野测试中,9只治疗眼中有6只(67%)的“基线时敏感度最低的5个及以上位点”改善≥7分贝;同时,最佳矫正视力与低亮度视觉视敏度也有统计学意义上的显著改善。图2展示了1名患者在治疗后9个月内的视网膜结构与功能改善情况。
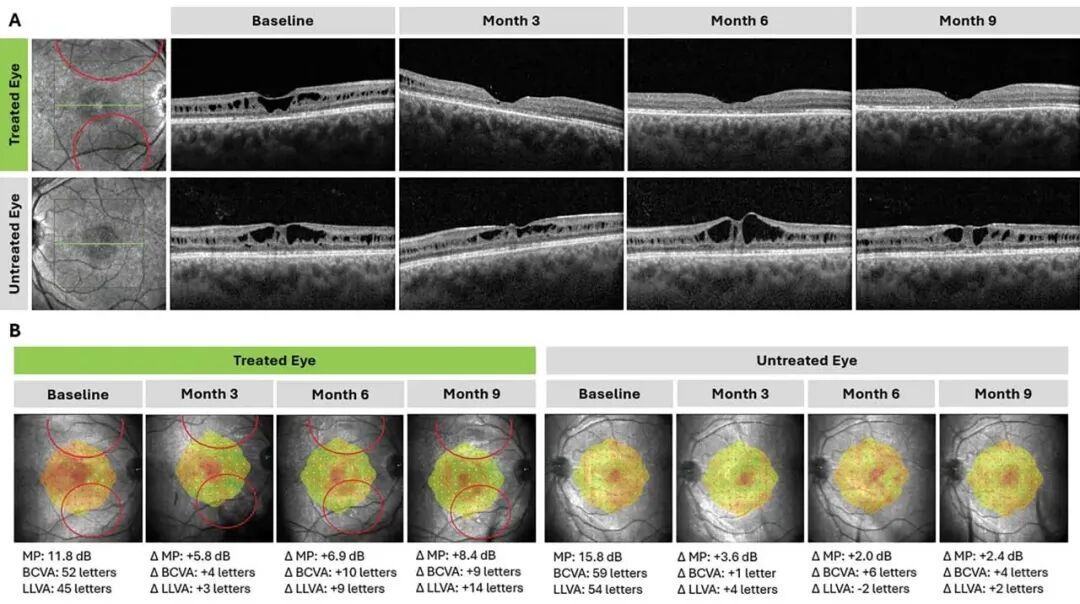
图2 接受 ATSN-201 治疗的患者的视网膜结构与功能变化。ATSN-201 通过视网膜下注射给药,在患者右眼形成2个给药泡(泡体位置以红色标注)。(A)治疗眼在第3个月时即观察到黄斑裂孔闭合,且该效果至少持续至第9个月,证明治疗效果具有持久性;未治疗眼在任何时间点均未观察到黄斑裂孔闭合。(B)与未治疗眼相比,治疗眼在微视野、最佳矫正视力和低亮度视觉视敏度方面均表现出功能改善。微视野阈值计算方式:以基线时敏感度最低的5个位点的平均值为基准,设定19分贝为阈值,若存在敏感度相同的位点则额外纳入计算
目前,该研究的 B 部分入组正在进行中,将额外纳入9名成年 X 连锁视网膜劈裂症患者和3名儿童 X 连锁视网膜劈裂症患者。成年队列将随机分为3组:低剂量组、高剂量组和对照组。对照组患者在接受12个月观察后,可选择接受治疗。
五、非基因依赖性研究项目
Nanoscope Therapeutics 公司正在研发非基因依赖性的视力恢复光遗传学疗法,旨在帮助数百万因视网膜退行性疾病失明的患者。MCO-010 是一款通过 AAV2 载体递送的多特征视蛋白转基因药物,通过单次玻璃体腔内注射给药,可转导双极细胞使其表达高感光性视蛋白,从而在患者感光细胞永久性丢失的情况下恢复视力(见图3)。
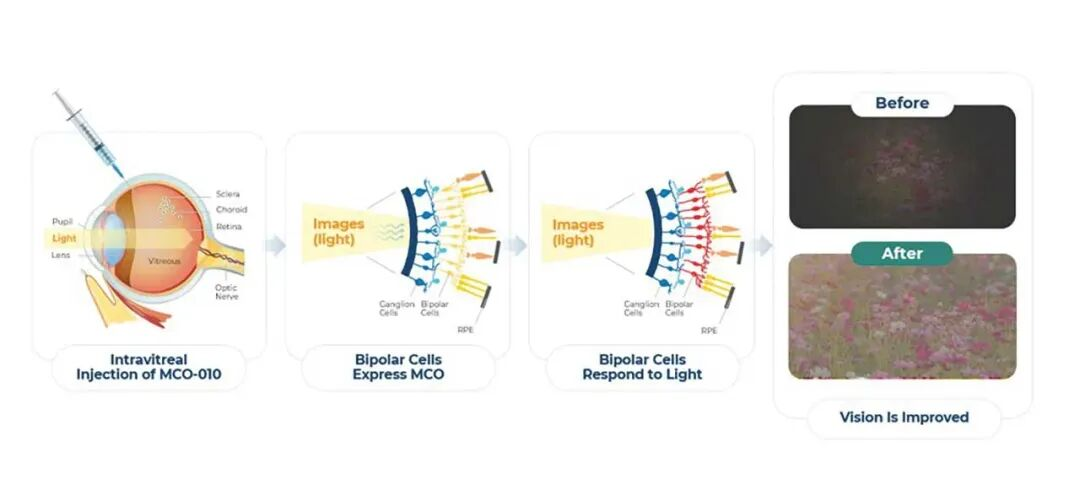
图3 MCO-010 通过 AAV2 载体以多特征视蛋白转基因的形式经玻璃体腔内注射给药,转导双极细胞使其表达感光性视蛋白
在 RESTORE 2b/3 期多中心随机对照临床试验中,该药物展现出积极结果:视网膜色素变性患者的视力改善达到0.3logMAR(相当于 ETDRS 视力表上提升3行),且疗效可稳定维持2.5年[16]。基于此,该公司已于2025年6月启动向美国 FDA 滚动提交生物制品许可申请的流程。若获批,MCO-010 有望成为视网膜色素变性患者的标准治疗方案,通过单次门诊注射给药,无需进行基因检测。此外,该公司在 STARLIGHT 2期临床试验中(评估 MCO-010 用于 Stargardt 病治疗的效果)也取得了良好结果[17],并计划于2025年启动3期注册试验。该公司的临床前项目包括针对 Leber 先天性黑矇的研究性新药支持研究,以及一款可用于地图样萎缩的研究性新药阶段药物。
如今,视网膜专科医生务必及时了解遗传性视网膜疾病基因治疗试验的现状,才能为遗传性视网膜疾病患者提供最佳、最新的临床管理方案。对于疑似遗传性视网膜疾病的患者,是直接转诊至遗传性视网膜疾病专科医生,还是在普通视网膜诊疗中心先开展基因检测,虽取决于医生的个人诊疗偏好,但视网膜专科医生对临床试验现状的了解越充分,就越能就适用的临床试验或潜在治疗方案与患者进行更有价值的沟通。
参考文献
[1] Stone EM, Aldave AJ, Drack AV, et al. Recommendations for genetic testing of inherited eye diseases: report of the American Academy of Ophthalmology task force on genetic testing.
[2] Gene therapy for X-linked retinitis pigmentosa (XLRP) retinitis pigmentosa GTPase regulator (RPGR). ClinicalTrials.gov identifier: NCT03252847. Updated January 8, 2025. Accessed September 8, 2025. https://www.clinicaltrials.gov/ct2/show/NCT03252847
[3] Michaelides M, Besirli CG, Yang Y, et al. Phase 1/2 AAV5-hRKp.RPGR (botaretigene sparoparvovec) gene therapy: safety and efficacy in rpgr-associated x-linked retinitis pigmentosa. Am J Ophthalmol. 2024;267:122-134. doi:10.1016/j.ajo.2024.05.034
[4] Gene therapy trial for the treatment of X-linked retinitis pigmentosa associated with variants in the RPGR gene. ClinicalTrials.gov identifier: NCT04671433. Updated April 25, 2025. Accessed September 8, 2025. https://www.clinicaltrials.gov/ct2/show/NCT04671433
[5] Clark M, Besirli C, Wong P, et al. Update on bota-vec efficacy and safety data in patients with RPGR-XLRP. Oral presentation presented at: FFB Retinal Therapeutics Innovation Summit 2025; May 2, 2025; Salt Lake City, UT, USA.
[6] A phase 2, open-label, multicenter study comparing two doses of AGTC-501 (laruparetigene zovaparvovec; DAWN) in male participants with X-linked retinitis pigmentosa (previously treated with AAV-based RPGR gene therapy). ClinicalTrials.gov identifier: NCT06275620. Updated October 30, 2024. Accessed September 8, 2025.
[7] A phase 2/3, randomized, controlled, masked, multicenter pivotal study evaluating two doses of laru-zova (AGTC-501/laruparetigene zovaparvovec) versus untreated control in male participants with X-linked retinitis pigmentosa (VISTA). ClinicalTrials.gov identifier: NCT04850118. Updated February 11, 2025. Accessed September 8, 2025. https://clinicaltrials.gov/study/NCT04850118
[8] ACDN-01-001: open-label, single ascending dose study to evaluate the safety, tolerability, and preliminary efficacy of subretinal ACDN-01 in participants with ABCA4-related retinopathy (STELLAR). ClinicalTrials.gov identifier: NCT06467344. Updated June 27, 2025. Accessed September 8, 2025. https://clinicaltrials.gov/study/NCT06467344
[9] SpliceBio. SpliceBio announces first patient dosed in Phase 1/2 ASTRA study of SB-007, a dual-AAV gene therapy for Stargardt disease [Press release]. March 13, 2025. https://splice.bio/splicebio-announces-first-patient-dosed-in-phase-1-2- astra-study-of-sb-007-a-dual-aav-gene-therapy-for-stargardt-disease/
[10] Favre D, Di Scala M, Aisa I, et al. Preclinical safety and efficacy of intein-based dual-AAV gene therapy for Stargardt disease. Invest Ophthalmol Vis Sci. 2024;65:6089. https://iovs.arvojournals.org/article.aspx?articleid=2800129
[11] Girach A, Favre D. Intein-based dual-AAV gene therapy for Stargardt disease. Presented at: 9th Annual Retinal Cell and Gene Therapy Innovation Summit; May 3, 2024; Seattle, WA.
[12] SpliceBio. SpliceBio announces U.S. FDA IND clearance of SB-007 to commence Phase 1/2 clinical study in patients with Stargardt disease. [Press release]. December 12, 2024. https://splice.bio/splicebio-announces-u-s-fda-ind-clearance-of- sb-007-to-commence-phase-1-2-clinical-study-in-patients-with-stargardt-disease/
[13] Yang P, Pardon LP, Ho AC, et al. Safety and efficacy of ATSN-101 in patients with Leber congenital amaurosis caused by biallelic mutations in GUCY2D: a phase 1/2, multicentre, open-label, unilateral dose escalation study. Lancet. 2024;404(10456):962-970. doi:10.1016/S0140-6736(24)01447-8
[14] Opus Genetics. Opus Genetics announces presentation of OPGX-LCA5 gene therapy data at ARVO; 12-month phase 1/2 results support potential to restore to meaningful vision. May 5, 2025. Accessed September 8, 2025. https://ir.opusgtx.com/press-releases/detail/484/opus-genetics-announces-presentation-of-opgx-lca5-gene-therapy-data-at-arvo-12-month-phase-12-results-support-potential-to-restore-to-meaningful-vision
[15] Atsena Therapeutics announces positive clinical data from part A of phase 1/2 trial evaluating ATSN-201 gene therapy to treat X-linked retinoschisis (XLRS). News release. May 19, 2025. Accessed September 8, 2025. https://www.atsenatx.com/press-release/atsena-therapeutics-announces-positive-clinical-data-from-part-a-of-phase-i-ii-trial-evaluating-atsn-201-gene-therapy-to-treat-x-linked-retinoschis/
[16] A phase 2b randomized, double-masked, sham-controlled study to evaluate the efficacy and safety of intravitreal injection of MCO-010 optogenetic therapy in adults with retinitis pigmentosa (RESTORE). ClinicalTrials.gov identifier: NCT04945772. Updated March 22, 2024. Accessed September 8, 2025. https://clinicaltrials.gov/study/NCT04945772
[17] Safety and effects of a single intravitreal injection of vMCO-010 optogenetic therapy in subjects with Stargardt disease (STARLIGHT). ClinicalTrials.gov identifier: NCT05417126. Updated November 9, 2023. Accessed September 8, 2025. https://clinicaltrials.gov/study/NCT05417126








